Електроліти – це речовини, які під час розчинення у воді (або іншому полярному розчиннику) чи розплавлення розпадаються на іони, і тому їх розчини або розплави проводять електричний струм.
Електроліти (при розчинені у воді) це більшість солей і гідроксидів простих металів, деякі кислоти (HCl, H2SO4, HNO3, HClO4). До слабких електролітів належать органічні кислоти, багато основ (NH3, Zn(OH)2), вода.
Розглянемо дослід
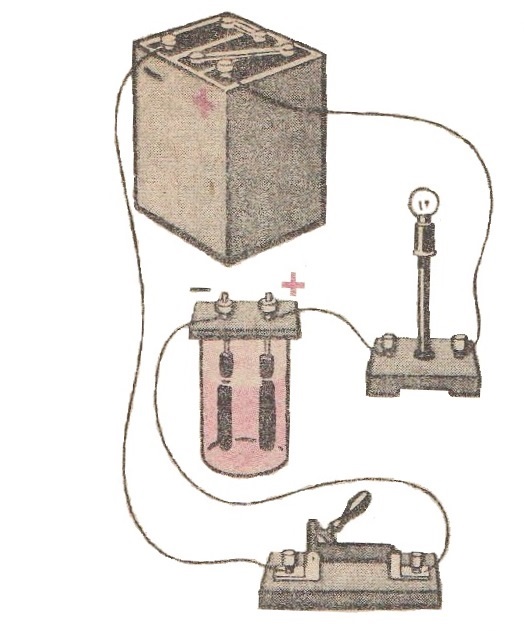
В посудину з дистильованою водою занурюють два чистих вугільних стержня – два електроди і з’єднують їх з електричною лампою, вмикають в коло джерела струму (рис 1).
Рис. 1
Лампочка не загоряється, отже, струму в колі немає. Це тому що дистильована вода не містить вільних зарядів.
Потім в воду добавляють деяку кількість розчину мідного купоросу. Лампочка при цьому загоряється (рис 2), в колі лампочки виникає струм.
Рис. 2
А якщо виникає струм, отже в розчині купоросу з’явились заряджені частинки. Кристали мідного купоросу, як і дистильована вода не являються провідниками струму. Але при розчиненні купоросу в воді його молекули взаємодіють з молекулами розчинника, розпадаються на частини. При цьому одна частинка від розпаду молекули виявляється зарядженою позитивно виникає позитивний іон, інша негативно – виникає негативний іон.
Електролітична дисоціація
Процес розпаду електроліту на іони називають електролітичною дисоціацією.
Класична теорія електролітичної дисоціації була створена С. Арреніус і В. Оствальдом в 1887 році. Арреніус дотримувався фізичної теорії розчинів, не брав до уваги взаємодію електроліту з водою і вважав, що в розчинах знаходяться вільні іони. Російські хіміки І. А. Каблуков і В. А. Кістяківський в 1891 році застосували для пояснення електролітичної дисоціації хімічну теорію розчинів Д. І. Менделєєва і довели, що при розчиненні електроліту відбувається його хімічна взаємодія з водою, в результаті якого електроліт дисоціює на іони.
Позитивні іони це частинки що втратили один або декілька електронів, негативні іони – це частинки які що мають один або декілька зайвих електронів.
Іони в розчині, як і молекули, рухаються хаотично, але якщо посудину з розчином розмістити в електричному полі, іони почнуть рухатись в напрямку руху електричних сил. Позитивні іони почнуть рухатись до електроду з негативним полюсом джерела струму – такий електрод називається катодом. До електроду що з’єднаний з позитивним полюсом джерела струму який називають анодом, будуть переміщуватись негативні іони.
В електроліті, таким чином виникає електричний струм, який являє собою упорядкований рух позитивних і негативних іонів.
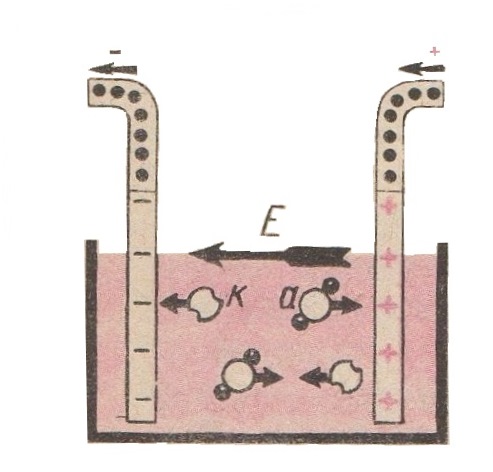
Схема руху іонів в електроліті зображена на (рис 3).
Рис. 3
На рисунку стрілкою Е показано направлення сил електричного поля, стрілкою k – направлення руху позитивних іонів і стрілкою а – негативних іонів.
В досліді з мідним купоросом позитивні іони міді, дійшовши до катода, віддають йому свій заряд і в вигляді нейтральних атомів осідають на цьому електроді. При проходженні через інші електроліти на електродах також осідає якась речовина.
Застосування електролітів
Електроліти відіграють важливу роль у різних сферах, зокрема:
- Хімічні джерела струму: Електроліти є основним компонентом, що використовуються в батарейках та акумуляторах. Вони забезпечують рух іонів між електродами, що генерує електричний струм.
- Електрохімія: Електроліти використовуються в процесах електролізу, де електричний струм використовується для проведення хімічних реакцій. Наприклад, електроліз застосовують для очищення металів та покриття їх тонкою плівкою іншого металу.
- Паливні елементи: Деякі типи паливних елементів використовують електроліт для забезпечення руху іонів між електродами, що генерує електричну енергію.