Атом – це основна одиниця матерії, що складається з елементарних частинок, таких як протони, нейтрони та електрони. Сучасна теорія атома була розроблена в кінці XIX століття та на початку XX століття, і вона стала ключовою в розвитку сучасної науки та технології.
У цій статті ми розглянемо властивості та будову атома, його історію від початку вивчення до сьогодення, а також застосування атомної науки в різних сферах.
Розвиток теорії атома
Ідея про те, що матерія складається з малих неподільних частинок, існувала вже в давнину. Атомістична теорія була запропонована давньогрецьким філософом Демокрітом у V столітті до нашої ери. За його теорією, атоми були неподільні частинками речовини, які не могли бути поділені на більш дрібні частинки.
У XVII столітті, англійський вчений Роберт Бойль встановив закон Бойля-Маріотта, який описує залежність між об’ємом газу та тиском. Цей закон був важливим кроком у розвитку науки про атоми, оскільки він вказував на те, що гази складалися з окремих частинок, які можуть взаємодіяти між собою.
У 1803 році Джон Далтон запропонував першу наукову теорію атома. За його теорією, атоми були неподільними частинками речовини, які не можуть бути поділені на більш дрібні частинки. Він також ввів поняття про вагу атома та встановив, що елементи складаються з атомів, які мають різну масу.
Модель атома Томсона
До 1897 року атоми вважали неподільними. 1897 року Джозеф Джон Томсон провів дослід з круксовою трубкою в якому вперше спостерігався електрон. На катод подавали деяку напругу і, як згодом виявилося, в таких умовах катод випромінює пучки електронів. Томсон з’ясував, що ці пучки відхиляються при впливі на них електромагнітного поля. Сам Томсон називав ці частинки корпускулами, але пізніше вони отримали окрему назву — електрони.
Модель атома Томсона, інколи ще її називають пудингова модель атома вважалася однією з перших моделей атома. За цією моделлю, атом складався з позитивно зарядженої сфери, у якій вкладені електрони. Вважалося, що електрони рухаються випадковим чином у цій хмарі.
Однак модель Томсона не пояснювала того, чому різні елементи мають різну зарядженість та масу. Крім того, вона не пояснювала того, чому атом не руйнується під час руху електронів.
Модель атома Томсона була замінена моделлю Резерфорда, яка вказувала на те, що атом складається з зарядженого ядра, у якому міститься більша частина маси атома, і з електронів, що рухаються навколо ядра.
Модель атома Резерфорда або планетарна модель атома
У 1911 році, англійський фізик Ернест Резерфорд виконав експеримент, який дав ключове відкриття для розуміння структури атома. Він випромінював альфа-частинки на тонкий лист фольги та спостерігав, як вони відбиваються.
Класичний дослід Резерфорда
Класичний дослід Резерфорда, який він провів у 1911 році, став вирішальним для розуміння структури атома. В досліді Резерфорд використовував тонкі золоту фольгу, на які він направляв потік альфа-частинок (ядра гелію).
Вузький пучок α-частинок зі свинцевого контейнера спрямовувався на тонку золоту фольгу, а далі потрапляв в екран, покритий шаром кристалів цинку сульфіду. Якщо в такий екран улучала α-частинка, то в місці її влучання відбувався слабкий спалах світла. Учені спостерігали спалахи за допомогою мікроскопа та реєстрували влучання α-частинок в екран. Переважна більшість α-частинок проходила крізь золоту фольгу, не змінюючи напрямку руху, деякі відхилялися від початкової траєкторії. А от приблизно одна з 20 000 частинок відскакувала від фольги.
Це вказувало на те, що зустрілися з якимось дуже масивним та позитивно зарядженим об’єктом, який повернув їх назад.
Резерфорд запропонував, що цим об’єктом є заряджений ядро атома, яке знаходиться в центрі атома. Він дав йому назву “протон”. Це було величезним кроком в розвитку моделі атома, оскільки відкриття протону дало можливість краще розуміти структуру атомів та їх хімічну поведінку.
Резерфорд запропонував планетарну модель атома:
Однак, з погляду класичної електродинаміки, електрон у моделі Резерфорда, рухаючись навколо ядра, мав би випромінювати енергію безперервно і дуже швидко і, втративши її, впасти на ядро.
Щоб подолати цю проблему була запропонована модель атома Бора в 1913 році фізиком Нільсом Бором. Ця модель передбачала, що електрони рухаються по визначених енергетичних рівнях навколо ядра атома, яке містить заряджений протон.
Модель атома Бора
У моделі Бора електрони, рухаючись по кругових орбітах, зберігають енергію у визначених енергетичних рівнях, які відповідають конкретним радіусам орбіт. Коли електрон переходить з одного рівня на інший, він випромінює або поглинає кванти світла (фотони), в результаті чого спостерігаються лінії спектра атома.
Модель Бора була важливим кроком у розвитку науки, оскільки вона дозволила пояснити багато хімічних та спектроскопічних властивостей атомів, а також знайти зв’язок між енергетичними рівнями та лініями спектра.
У 1932 році, англійський фізик Джеймс Чедвік відкрив нейтрон, який був третьою складовою частинкою атома, разом з протонами та електронами. Нейтрон не має електричного заряду та має масу, що приблизно рівна масі протону. Це розширило наше розуміння атома та дало змогу вивчити більше його властивостей.
Сьогодні, наука про атом, відома як атомна фізика, продовжує розвиватись та дає змогу нам краще розуміти світ навколо нас.
Будова атома
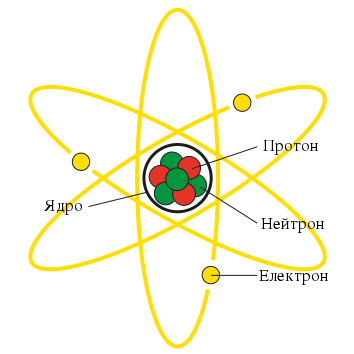
Атом складається з трьох основних складових частинок – електронів, протонів та нейтронів. Електрони є негативно зарядженими частинками, які рухаються навколо ядра атома. Протони є позитивно зарядженими частинками, які знаходяться в ядрі атома разом з нейтронами. Нейтрони не мають заряду, але мають масу, яка приблизно рівна масі протону.
Протони мають позитивний заряд, а нейтрони не мають заряду, але разом вони утворюють ядро, яке є позитивно зарядженим через протони.
Ядро атома – це центральна частина атома, що містить більшу частину його маси. Протони та нейтрони пов’язані разом за допомогою ядерних сил.
Кількість протонів у ядрі визначає його хімічні властивості та визначає, який елемент воно представляє.
Ядро атома знаходиться в центрі атома та оточене хмарою електронів, які утворюють електронну оболонку. Електрони перебувають у русі навколо ядра, та його рух визначає хімічні та фізичні властивості атома
Кількість протонів у ядрі атома визначає його атомний номер та визначає, який елемент хімічної таблиці він представляє.
Кількість нейтронів у ядрі може варіюватись, створюючи так звані ізотопи, які мають однакову кількість протонів, але різну кількість нейтронів.
Енергія електронів, які рухаються навколо ядра атома, може приймати дискретні значення. Це значить, що електрони можуть перебувати тільки в певних енергетичних станах, які визначаються їх відстанню від ядра та швидкістю руху. Коли електрон переходить з одного енергетичного стану в інший, він випромінює або поглинає кванти світла, які називаються фотонами.
Розмір атома
Розмір атома залежить від його електронної конфігурації та від енергетичного стану. Загалом, розмір атома збільшується зі збільшенням кількості електронів у ньому, а також зі збільшенням номеру атома в періодичній таблиці.
Для опису розміру атома використовують радіус атома, який визначається відстанню від центру ядра до зовнішнього “облачка” електронів, де ймовірність знаходження електрона максимальна. Радіус атома може бути визначений експериментально, наприклад, за допомогою розсіювання рентгенівських променів.
Найбільші атоми в періодичній таблиці періодичних законів є францій (Fr) та цезій (Cs) з радіусами близько 260 пікометрів, а найменші атоми – гелій (He) та гелійоподібний іон (H-) з радіусами близько 31 пікометр
Атомна маса
Основну масу атома зосереджено у ядрі, яке складається з нуклонів: протонів і нейтронів, зв’язаних між собою силами ядерної взаємодії.
Маса атома – це маса основного стану атома, визначена в атомних одиницях маси (а. о. м.). Один атом водню має масу близько 1 а. о. м. Маса атомів інших елементів відрізняється в залежності від кількості протонів та нейтронів у ядрі.
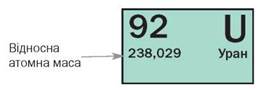
У таблиці хімічних елементів маса атома вказується поряд із символом елементу та його атомним номером.
Маса атома вимірюється в одиницях маси, де одна а. о. м. відповідає одній дванадцятій маси атома вуглецю-12. Значення маси атома можуть бути визначені експериментально, наприклад, за допомогою мас-спектрометрії.
Найлегший елемент – водень (H) – має масу атома близько 1 а. о. м. Найважчий стійкий елемент – свинець (Pb) – має масу атома близько 207 а. о. м. Однак, є елементи зі штучною створеною найважчою масою атома, такі як елементи зі штучною створеною масою атома, наприклад, коперницій (Cn), має масу атома близько 285 а. о. м.
Ізотопи
Як вже згадувалося, ізотопи – це атоми, що мають однакову кількість протонів, але різну кількість нейтронів у ядрі. Наприклад, водень має один протон та нуль нейтронів у ядрі, а його ізотоп дейтерій має один протон та один нейтрон у ядрі. Ізотопи мають різну масу, тому їхні властивості можуть бути трохи відмінні одне від одного.
Сучасній науці відомо 114 видів атомів. Шляхом комбінації різних видів атомів утворюються молекули, із яких складається речовина.
Візуалізація атома
Атоми не можна прямо побачити, оскільки вони занадто малі для оптичних мікроскопів. Але наука знаходить різні способи візуалізації атомів, щоб вивчити їх властивості та поведінку.
Один з методів візуалізації атомів – це застосування тунельного мікроскопу. Цей прилад дозволяє “бачити” атом за допомогою ефекту тунелювання електронів. Електрони заряджають поверхню зразка, на якому розташовані атоми, та взаємодіють з електронами на поверхні мікроскопу. Це дозволяє отримати зображення атомів з дуже високою роздільною здатністю.
Інший метод – це використання рентгенівської дифракції, яка дозволяє отримати інформацію про структуру кристалів, які складаються з атомів. Коли рентгенівські промені проходять крізь кристал, вони дифрагуються на атомах, і це дозволяє вивчити їхню структуру.
Існують також інші методи візуалізації атомів, такі як скануюча електронна мікроскопія (SEM) та трансмісійна електронна мікроскопія (TEM), які використовуються для вивчення структури твердих тіл та матеріалів, що містять атоми.
Незважаючи на те, що атом не можна прямо побачити, вивчення їх властивостей та поведінки дозволяє науці розуміти природу речовин та розвивати нові матеріали та технології.
Часті запитання:
Атом складається з трьох основних складових частинок – електронів, протонів та нейтронів.
у центрі атома знаходиться позитивно заряджене ядро, що складається з протонів та нейтронів.
Планетарна модель.