Гальванічний елемент — це хімічне джерело електричного струму, в якому використовується різниця електродних потенціалів двох металів, або їх оксидів занурених у електроліт.
Перехід хімічної енергії в електричну енергію відбувається у гальванічних елементах.
Історія винайдення гальванічного елементу
Гальванічний елемент названий на честь Луїджі Гальвані італійського фізіолога, професора медицини Болонського університету, досліди якого дали поштовх до дослідження Вольти. Гальвані виявив, що свіжо препарована жаб’яча лапка підвішена на мідному крючку до залізної перекладини, щоразу скорочується коли доторкається до заліза. Якщо жаб’ячю лапку з’єднати з залізною перекладиною за допомогою залізної палички то м’язи швитко скоротяться. В той час не знали що лапки скорочуються при пропусканні через неї електричного заряду, то Гальвані помилково вирішив що електричні заряди виробляються в наслідок якихось життєвих процесів в лапках жаби.
Алессандро Вольта вияснив, що це явище викликано наявністю двох різних металів (мідного крючка та залізної перекладини), доторкаючись до електролітів (рідиною в жаб’ячій лапці та шаром вологи, що покривають в звичайних умовах всі металеві предмети), а жаб’яча лапка грала роль лише чутливого приладу який реагував на наявність струму.
Гальванічний елемент Вольта
У 1800 р. А. Вольта сконструював пристрій, що виробляв електричний струм. Пристрій складався з двох металевих пластин — мідної та цинкової, між якими поміщалася тканина, заздалегідь просякнута розчином сульфатної кислоти. До пластин були припаяні дроти, які занурювали у воду. На поверхні дротів виділявся газ, що вказувало на проходження крізь воду електричного струму.
Саме це найпростіше хімічне джерело струму він назвав гальванічним елементом, на честь Л. Гальвані.
Гальванічний елемент Даніеля-Якобі
Удосконаленням першого гальванічного елемента займалися англійський хімік Дж. Ф. Даніель і незалежно від нього німецький та російський фізик-винахідник Б. С. Якобі.

При замиканні е- перерходять з цинкової пластини в мідну.
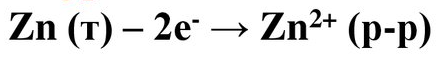
Йони Zn2+ з цинкового електрода переходять в розчин. Цинкова пластина розчиняється.
На цинковому електроді протікає напівреакція окислення.
Йони Cu2+ осідають з розчину на мідний електрод.
На мідному електроді протікає напівреакція відновлення.

В цілому реакцію можна розглядати як окисно-відновлювальну

Принцип роботи будь-якого гальванічного елемента заснований на окисно-відновних процесах, що відбуваються на катоді і аноді. Значення номінальної напруги та термін служби буде змінюватися залежно від використовуваного металу, вибраного розчину електроліту. Гальванічні елементи з розчином не дуже зручні у використанні, тому з часом сухі гальванічні елементи знайшли широке застосування. Сьогодні первинні елементи називають батарейками і є поширеним і зручним джерелом енергії. Вони використовуються у всіх портативних пристроях, які не підключені до електричного струму.
Класифікація гальванічних елементів
- Гальванічний первинний елемент — це пристрій, який використовується для безпосереднього перетворення хімічної енергії, реагентів (окислювачів і відновників), що містяться в ньому, в електричну енергію. Реагент, що міститься в джерелі, витрачається під час його роботи, і дія припиняється після того, як реагент буде вичерпано. Прикладом первинної батареї є батарея Даніеля-Якобі.
- Вторинні джерела струму (акумулятори) – це пристрої, в яких електрична енергія зовнішнього джерела струму перетворюється на хімічну енергію і накопичується, а хімічна – знову перетворюється на електричну. Одним із найпоширеніших акумуляторів є свинцевий (або кислотний).
- Електрохімічні генератори (паливні елементи) — це елементи, які перетворюють хімічну енергію в електричну. Окислювачі та відновники зберігаються поза елементом і під час роботи безперервно й окремо подаються до електродів. Під час роботи паливного елемента електроди не витрачаються.

