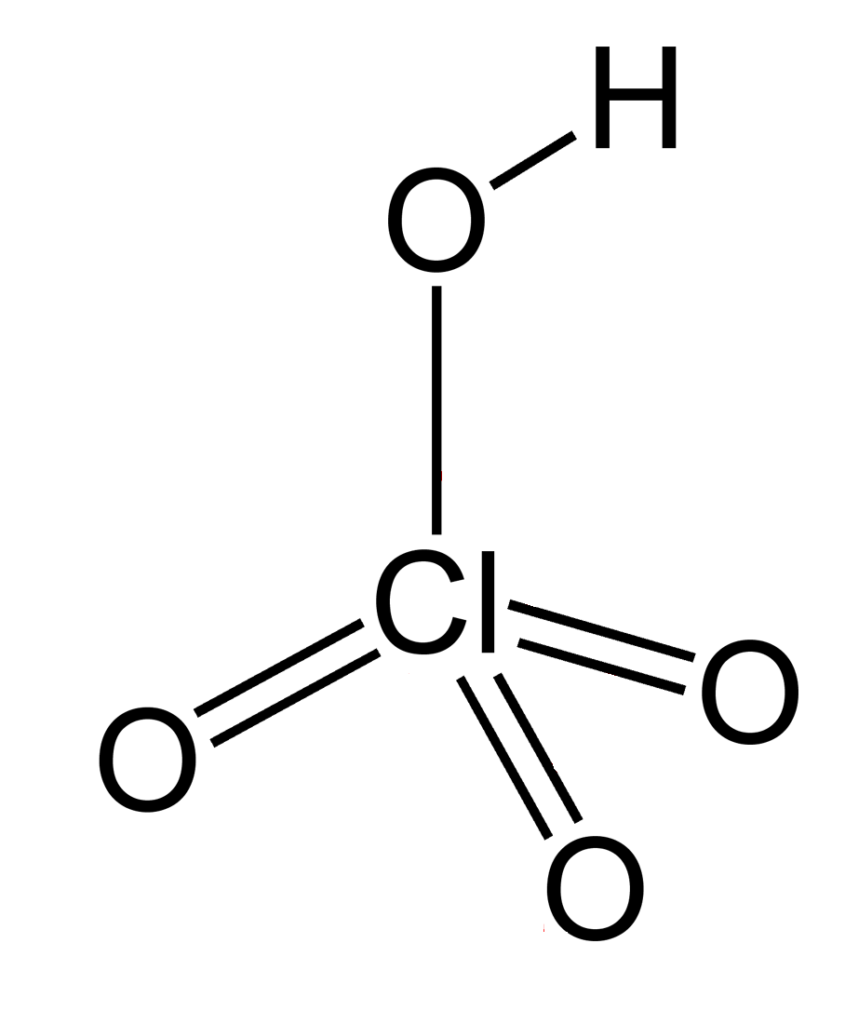
Перхлоратна кислота (HClO4) – це сильна неорганічна кислота (у водному розчині), безводна — сильний окисник. Вибухонебезпечна. Безбарвна летюча рідина, сильно димить на повітрі, в парах існує у вигляді мономеру.
Хімічні властивості
Перхлоратна кислота (HClO4) має наступні хімічні властивості:
- Дисоціація: У водних розчинах перхлоратна кислота дисоціює, утворюючи перхлоратні іони (ClO4-) та протони (H+). Дисоціація відбувається згідно з рівнянням: HClO4 → H+ + ClO4-
- Сильна кислотність: Перхлоратна кислота є однією з найсильніших неорганічних кислот. Вона має дуже низьке значення рН у водних розчинах. Це зумовлено високою ступінью дисоціації та здатністю віддавати протони.
- Окислювальні властивості: HClO4 є сильним окислювачем. Вона здатна окислювати багато речовин, включаючи органічні сполуки та низькомолекулярні спирти.
- Реакція з основами: Перхлоратна кислота реагує з лугами, утворюючи перхлоратні солі. Наприклад: HClO4 + NaOH → NaClO4 + H2O
- Стійкість: HClO4 є стійкою до саморозкладу при нормальних умовах. Вона має високу стабільність, яка дозволяє їй бути довго зберіганою.
- Реакція з металами: Деякі метали можуть реагувати з перхлоратною кислотою, особливо за підвищених умов, внаслідок її окислювальних властивостей.
Важливо враховувати, що перхлоратна кислота є потенційно небезпечною речовиною та повинні бути дотримані відповідні заходи безпеки під час роботи з нею.
Отримання
Перхлоратну кислоту (HClO4) можна отримати декількома способами. Один з них – це окиснення хлористоводню (HCl) хлоратною сульфатною сумішшю.
Ось загальна реакція:
6 HCl + H2SO4 + MnO2 → 3 HClO4 + MnSO4 + 2 H2O
У цій реакції хлористоводень окислюється до перхлоратної кислоти за наявності хлорату марганцю (IV) (MnO2) і сульфатної кислоти (H2SO4). Утворюються перхлоратна кислота, сульфат марганцю (MnSO4) і вода.
Інший метод отримання перхлоратної кислоти включає окиснення хлоратів або хлоритів сильним окислювачем, таким як хромати, пероксиди або персульфати.
Варто підкреслити, що HClO4 є потужною окислювальною речовиною, і робота з нею повинна проводитися з дотриманням відповідних заходів безпеки та в спеціально обладнаних лабораторних умовах.
Застосування
Перхлоратна кислота (HClO4) і її солі, перхлорати, мають різноманітні застосування у різних галузях. Деякі з них включають:
- Ракетна технологія: HClO4 і перхлорати використовуються як окислювачі в складниках ракетних палив. Вони забезпечують велику енергетичну видачу та високу стабільність, що робить їх корисними для космічних і ракетних досліджень.
- Піротехніка: Перхлоратні солі широко використовуються у піротехніці, включаючи феєрверки, сигнальні ракети та петарди. Вони забезпечують потужне окислювання та яскраві колірні ефекти.
- Батареї: Деякі типи літійових батарей використовують перхлорати як окислювачі. Це допомагає забезпечити високу енергетичну ємність та довгий термін служби батарей.
- Аналітична хімія: HClO4 використовується як реагент у деяких аналітичних методах, зокрема у вимірюванні вмісту азоту в органічних сполуках.
- Лабораторні дослідження: Перхлорати використовуються як стабільні окислювальні речовини у хімічних дослідженнях та синтезі органічних сполук.
Важливо враховувати, що перхлоратна кислота і перхлорати є потенційно небезпечними речовинами. Робота з ними повинна проводитися з дотриманням відповідних заходів безпеки та відповідних лабораторних протоколів.