Метан (CH4) – це найпростіший алкан і головний компонент природного газу. Він складається з одного атома вуглецю, зв’язаного з чотирма атомами водню. Метан є безбарвним та беззапаховим газом при нормальних умовах.
Метан є потужним парниковим газом і має велике значення в контексті зміни клімату. Він може виходити в атмосферу під час природних процесів (наприклад, багаторічних замерзлих ґрунтів або боліт) або в результаті антропогенної діяльності, такої як видобуток та транспортування нафти та газу, звалища відходів та сільське господарство.
| Інші назви | болотний газ природнийгаз карбону тетрагідрид карбюрований гідроген гідрогену карбід |
Молекулярна формула метану
CH4
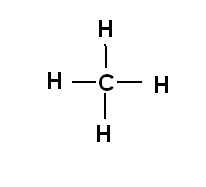
Структурна формула метану
В структурній формулі атом вуглецю (C) має чотири валентні електрони і утворює чотири одинарних ковалентних зв’язки з атомами водню (H), утворюючи таким чином молекулу метану (CH4).
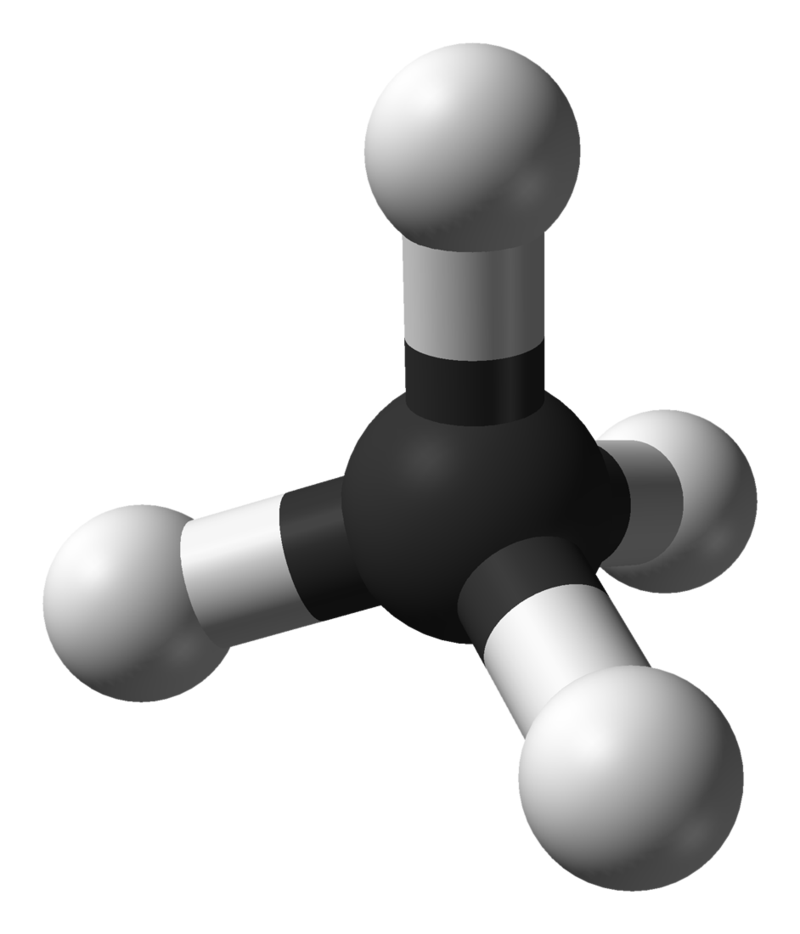
Кулестержнева модель метану
Фізичні властивості метану
Метан (CH4) має наступні фізичні властивості:
- Агрегатний стан: Метан є газом при нормальних умовах температури і тиску. Його кипіння відбувається при температурі -161,5 °C (-258,7 °F), а замерзання при температурі -182,5 °C (-296,5 °F).
- Безбарвний і беззапаховий: CH4 сам по собі безбарвний і беззапаховий. Однак у деяких випадках до метану додають запахові речовини, щоб легше виявляти його наявність, оскільки метан без запаху і висока концентрація може бути небезпечною, тому додавання запаху дозволяє раннє виявлення витоку газу.
- Низька густина: Густина метану при нормальних умовах температури і тиску становить близько 0,717 кг/м³. Це робить його легким газом, який може швидко розповсюджуватися у повітрі.
- Низька розчинність: Метан має низьку розчинність у воді. При нормальних умовах, лише обмежена кількість метану може розчинятися в воді.
- Високий показник горючості: CH4 є дуже горючим газом, він змішується з повітрям і утворює вибухонебезпечні суміші, які можуть запалюватися легкою іскрою або відкритим вогнем.
- Низький тиск парів: Метан має низький тиск парів при нормальних умовах, що робить його менш небезпечним з точки зору пароутворення порівняно з іншими вуглеводневими сполуками.
Хімічні властивості метану
Метан (CH4) має такі хімічні властивості:
- Горіння: CH4 є дуже горючим газом. Він реагує з киснем у присутності вогню або іскри, утворюючи воду (H2O) і викидаючи діоксид вуглецю (CO2) і енергію. Реакція горіння метану є екзотермічною (виділяє тепло).
- Окиснення: Метан може бути окислений за участю інших окислювачів, таких як хлор (Cl2) або бром (Br2). У таких реакціях утворюються галогеновмісні похідні метану.
- Гідрогенування: Метан може піддаватися реакції гідрогенування, де він реагує з молекулярним воднем (H2) у присутності каталізатора, утворюючи більш складні алкани.
- Галогенація: CH4 може взаємодіяти з галогенами (хлором, бромом або йодом) у присутності світла або каталізаторів. У результаті цих реакцій утворюються галогеновмісні похідні метану.
- Окислення: Метан може бути окислений до формальдегіду (CH2O) та більш високих окисних форм в присутності окисників, таких як перекис водню (H2O2) або кисень (O2).
- Підкислення: Метан може реагувати з кислотами, утворюючи солі метану. Наприклад, реакція метану з хлороводнем (HCl) призводить до утворення хлориду метилу (CH3Cl).
- Полімеризація: CH4 може бути підданий полімеризації, де він утворює полімери, такі як поліетилен.
Добування метану
Метан може бути добутий з різних джерел, включаючи природні газові родовища, біогаз, вугілля та гідрати метану.
Ось деякі методи добування метану:
- Природні газові родовища: Основним джерелом метану є природні газові родовища, де він знаходиться у складі земного газу. Добування природного газу включає бурові роботи для отримання доступу до пластів, де знаходиться газ, та використання спеціального обладнання для вилучення газу на поверхню.
- Біогаз: Метан може бути видобутий з біологічних джерел, таких як навоз, стічні води, біологічні відходи та органічні матеріали. Цей процес відбувається у біогазових установках, де відбувається бродіння органічних речовин бактеріями без доступу до кисню.
- Вугілля: Метан може бути видобутий з вугілля в процесі вуглеводневої газифікації. У цьому процесі вугілля піддається високим температурам і тиску, що дозволяє вилучити метан з вуглеводневих сполук у вугільних родовищах.
- Гідрати метану: Гідрати метану є замороженими формами метану, які знаходяться у вигляді кристалічних структур в океанському дні або у деяких льодовиках. Добування гідратів метану є складним процесом, оскільки вони знаходяться на великій глибині та вимагають спеціальних технологій для їх розробки.
- Синтетичний метан: Метан також може бути вироблений шляхом хімічних реакцій, таких як синтез газу (вуглекислий газ і водень) або метаногенез (реакції між окисниками та органічними сполуками).
Ці методи добування метану використовуються залежно від доступності джерел та вимог до метану у конкретній галузі.
Застосування метану
Метан має різноманітні застосування у різних галузях.
Ось деякі основні області використання метану:
- Енергетика: Метан є важливим джерелом енергії. Він використовується як природний газ для опалення будівель, виробництва електроенергії та внутрішнього спалювання у газових турбінах та двигунах.
- Транспорт: CH4 може бути використаний як паливо для газових автомобілів та автобусів. Використання метану як альтернативного палива може допомогти знизити залежність від нафтопродуктів та зменшити викиди шкідливих речовин.
- Промисловість: Метан використовується як сировина для виробництва різноманітних хімічних продуктів, таких як метанол, формальдегід, ацетілен, синтетичний газ та інші органічні сполуки.
- Сільське господарство: CH4 виникає під час бродіння органічних матеріалів, таких як навоз, у вигляді біогазу. Цей біогаз може бути використаний як джерело енергії для опалення, електропостачання та заміщення інших палив у сільському господарстві.
- Геологічне зберігання: CH4 може бути збережений у підземних резервуарах або підводних газових нафтових сховищах для майбутнього використання.
- Криогеніка: Завдяки своїй низькій температурі кипіння (-161,5 °C), метан може бути використаний як холодоносій у криогенній технології, наприклад, для охолодження реакторів або вакуумних систем.
- Астрономія: Метан є важливим газом у вивченні атмосфер планет, зокрема Юпітера, Сатурна та інших газових гігантів.
Застосування метану в різних галузях свідчить про його значення як палива, сировини та енергетичного ресурсу.