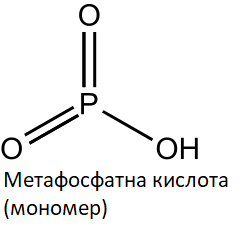
Метафосфатна кислота (HPO3) – це неорганічна кислота, яка складається з фосфору, кисню і водню. Вона має безбарвний або слабо жовтивий колір і є досить хімічно активною сполукою.
Хімічні властивості метафосфатної кислоти
Метафосфатна кислота (HPO3) має деякі хімічні властивості, які варто враховувати:
- Кислотність: Метафосфатна кислота є слабкою кислотою. У розчині вона дисоціює, звільняючи протони (H+), що здатні реагувати з базами. Дисоціаційний процес може бути представлений рівнянням: HPO3 ⇌ H+ + PO33-
- Окиснювальні властивості: HPO3 має обмежені окиснювальні властивості. Вона може взаємодіяти з деякими речовинами, відновлюючи їх і перетворюючись на фосфатні сполуки. Наприклад, вона може окислювати деякі неорганічні й органічні сполуки, такі як йодид калію (KI), формальдегід (CH2O) тощо.
- Реакції з основами: HPO3 може реагувати з основами, утворюючи фосфатні солі. Наприклад, реакція з гідроксидом натрію (NaOH) може мати наступний хімічний вигляд: HPO3 + 2NaOH → Na2HPO3 + H2O
- Дегідратація: Метафосфатна кислота може піддаватися дегідратації, утворюючи поліфосфати. При нагріванні вона може перетворитися на фосфорну кислоту (H3PO4) шляхом видалення молекул води.HPO3 → H3PO4 – H2O
- Утворення солей: Метафосфатна кислота може утворювати солі з різними металами. Ці метафосфатні солі можуть мати різні застосування, включаючи використання у харчовій промисловості, металургії, кераміці й електроніці.
Враховуйте, що HPO3 є потенційно небезпечною речовиною, й використання її повинно здійснюватися з дотриманням відповідних заходів безпеки й регуляційних вимог.
Отримання метафосфатної кислоти
Отримання метафосфатної кислоти (HPO3) може відбуватися декількома способами. Одним з найпоширеніших методів є окислення фосфорної кислоти (H3PO4) за допомогою сильного окислювача, такого як хлорат калію (KClO3) або пероксид водню (H2O2). Реакція може мати наступний хімічний вигляд:
2H3PO4 + KClO3 → 2HPO3 + KCl + 2H2O + O2
У цій реакції фосфорна кислота окислюється до метафосфатної кислоти, при цьому утворюються калій хлорид, вода і кисень.
Інший метод отримання метафосфатної кислоти включає термічний розклад пірофосфату амонію [(NH4)4P2O7]. При нагріванні пірофосфат амонію розпадається на метафосфатну кислоту та аміак:
(NH4)4P2O7 → 2HPO3 + 4NH3 + H2O
Утворена метафосфатна кислота може бути виділена та очищена за допомогою подальших процесів забезпечення чистоти продукту.
Враховуйте, що проведення цих реакцій повинно здійснюватися з урахуванням відповідних умов, безпеки й регуляційних вимог.
Застосування метафосфатної кислоти
Метафосфатна кислота (HPO3) та її солі (метафосфати) мають декілька застосувань:
- Харчова промисловість: Метафосфатні солі використовуються як стабілізатори та регулятори pH у харчовій промисловості. Вони додаються до м’ясних продуктів, морепродуктів, сирів та напоїв, щоб поліпшити структуру, тривалість зберігання та якість.
- Переробка м’яса: Метафосфатна кислота і метафосфатні солі використовуються в м’ясній промисловості для підвищення водозбереження, покращення текстури й якості м’ясних продуктів, таких як шинка, ковбаси й сосиски.
- Металургія: Метафосфатна кислота застосовується у металургійних процесах, зокрема для зняття оксидів, фосфатування металів та обробки поверхонь металевих деталей.
- Електроліт у батареях: Метафосфатна кислота використовується як електроліт у деяких типах акумуляторів, наприклад, у нікель-метал-гідридних (NiMH) або літій-залізо-фосфатних (LiFePO4) батареях.
- Хімічні дослідження: Метафосфатна кислота використовується у лабораторних умовах для різних хімічних досліджень, зокрема в аналітичній хімії та фармацевтичних дослідженнях.
Враховуйте, що використання метафосфатної кислоти повинно здійснюватися з дотриманням відповідних заходів безпеки та регуляційних вимог.