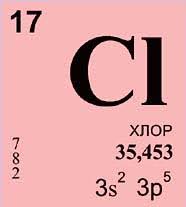Хлор (Cl) – це хімічний елемент з атомним номером 17. Він належить до галогенів і є одним з найбільш розповсюджених хімічних елементів в земній корі.
Фізичні властивості хлору
- Хлор має зеленувато-жовтий колір і неприємний запах.
- Хлор – досить розчинний у воді і низькомолекулярних спиртах.
- Точка плавлення хлору становить -101 градусів Цельсія, а точка кипіння -34 градуси Цельсія.
- Наявний у природі у вигляді діатомічного молекулярного газу (Cl2), а також у вигляді різноманітних сполук, наприклад, натрій хлориду (NaCl) або калій хлориду (KCl).
Хімічні властивості хлору
- Окиснення: Хлор може мати окиснення -1, +1, +3, +5 та +7.
- Реактивність: Хлор є дуже реактивним елементом, який легко реагує з багатьма іншими елементами та сполуками.
- Взаємодія з металами: Реагує з більшістю металів, щоб утворити хлориди. Деякі метали, такі як золото та платина, не реагують з хлором.
- Утворення хлоридів: Утворює хлориди з багатьма неорганічними та органічними сполуками. Наприклад, натрій хлорид (NaCl) є основним хлоридом, який зустрічається в природі.
- Реакція з водою: Хлор реагує з водою, утворюючи хідкі хлоридну кислоту (HCl) та гіпохлоритну кислоту (HClO).
- Реакція з киснем: Реагує з киснем, утворюючи діоксид хлору (ClO2), триоксид хлору (Cl2O3) та п’ятиокись хлору (Cl2O5).
- Реакція з амоніаком: Хлор реагує з амоніаком, утворюючи хлорид амонію (NH4Cl).
- Реакція зі спиртами: Може реагувати зі спиртами, утворюючи галогенетери.
- Каталізатор: Хлор може виступати як каталізатор у хімічних реакціях
Ізотопи хлору
Ізотопи хлору мають різну кількість нейтронів у ядрі, але однакову кількість протонів, тобто вони мають однаковий атомний номер, але різну атомну масу. Найбільш поширеними ізотопами хлору є 35Cl та 37Cl.
35Cl складається з 17 протонів та 18 нейтронів, тоді як 37Cl має 17 протонів та 20 нейтронів. Деякі інші ізотопи хлору також відомі, але вони мають крайньо низьку кількість атомів у природі. Наприклад, 36Cl – радіоактивний ізотоп, що утворюється в природі шляхом взаємодії космічних променів з атмосферними молекулами.
Ізотоп 35Cl є стабільним, тоді як 37Cl є слабо радіоактивним з періодом напіврозпаду близько 30 років. Обидва ізотопи є нерадіоактивними та широко використовуються в хімії та інших галузях науки.
Токсичність хлору
Хлор – це досить токсичний газ, який може бути небезпечним для здоров’я людини, якщо він надходить у великих концентраціях або в довготривалий період часу. Велика концентрація хлору може спричинити подразнення очей, носа та горла, кашель, запаморочення, головний біль, нудоту, слабкість та інші симптоми. У випадках важкого отруєння хлором може виникнути задишка, бронхіт, пневмонія та інші серйозні ускладнення дихальних шляхів. Для захисту від токсичної дії хлору необхідно використовувати захисні засоби, такі як маски, а також дотримуватись правил безпеки при роботі з хлором.
Застосування хлору
Хлор має широке застосування в промисловості і в побуті:
- Виробництво полімерів: хлор є важливою сировиною для виробництва полівінілхлориду (ПВХ), одного з найбільш використовуваних полімерів у світі.
- Виробництво побутових хімічних продуктів: використовується в виробництві побутових хімічних продуктів, таких як відбілювачі, миючі засоби та дезинфікуючі засоби.
- Виробництво пестицидів: хлор використовується у виробництві пестицидів, таких як діоксин, інсектициди та фунгіциди.
- Виробництво ставних матеріалів: використовується для виробництва більшості ставних матеріалів, таких як сплави алюмінію, міді та інших металів.
- Обробка води: використовується для очищення води від бактерій та інших мікроорганізмів.
- Виробництво скла: використовується для виробництва скла та скляних виробів.
- Медицина: хлор використовується в медицині як дезинфікуючий засіб.
- Енергетика: хлор використовується у виробництві водневих паливних елементів та акумуляторів.
- Виробництво паперу: використовується в виробництві паперу для відбілювання та очищення деревини.
Це далеко не повний список застосувань хлору. Оскільки хлор є таким універсальним та важливим елементом, він зустрічається в багатьох промислових процесах і продуктах.