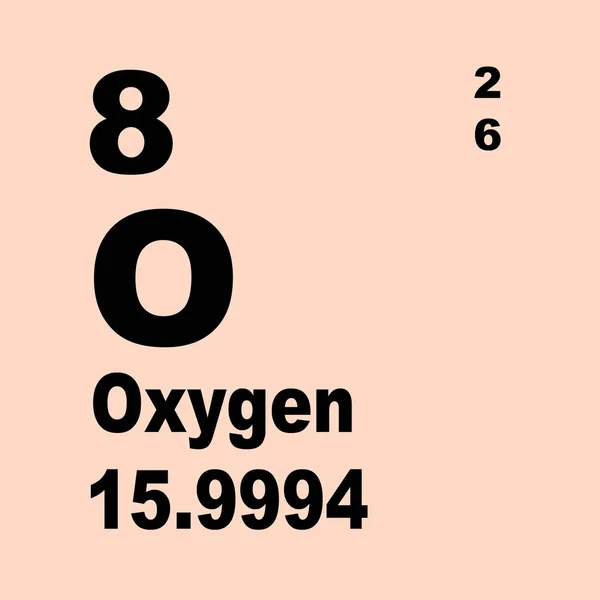Оксиген (Oxygen) – це хімічний елемент з атомним номером 8 в періодичній таблиці. Це найбільш поширений хімічний елемент у земній атмосфері, де він складає близько 21% об’єму повітря.
Оксиген має безбарвний, без запаху і без смаку газовий стан. Цей елемент відносно реактивний і здатний легко зв’язуватися з іншими елементами та сполуками. Оксиген утворює сполуки з більшістю інших хімічних елементів, у тому числі з металами, неметалами, вуглецем, азотом, воднем та іншими.
Хімічні властивості оксигену
Оксиген є високореактивним елементом і здатний утворювати сполуки з більшістю інших елементів. Основні хімічні властивості оксигену включають:
- Оксидуючі властивості: Здатний окислювати інші елементи та сполуки. Ця властивість робить його важливим компонентом в хімічних процесах, таких як дихання, де оксиген окислює органічні сполуки, щоб забезпечити енергію для клітин.
- Формування сполук з водою: Оксиген утворює стійкі сполуки з водою, такі як H2O, які є важливими для біологічних та хімічних процесів.
- Формування оксидів: Оксиген утворює різні оксиди з іншими елементами, наприклад, CO2, SO2, NO2 тощо. Ці сполуки мають різні властивості і використовуються в різних галузях, таких як промисловість, забезпечення енергії та ін.
- Формування перекисів: Оксиген утворює перекисі з більшістю елементів, таких як вуглецю, сірки та ін. Ці сполуки можуть бути стійкими або нерівноважними і дуже реактивними.
- Формування озону: Оксиген утворює озон (O3) у високих шарах земної атмосфери, який захищає нашу планету від шкідливої ультрафіолетової радіації.
- Стабільність: Оксиген має високу електронегативність, що робить його стійким і нездатним до взаємодії з деякими елементами.
Фізичні властивості оксигену
- Температура кипіння і температура замерзання: Температура кипіння кисню становить -183 °C, а температура замерзання становить -219 °C.
- Густина: Густина оксигену становить 1,429 г/см³ при стандартних умовах тиску та температури.
- Розчинність: Оксиген розчиняється в воді та деяких інших розчинниках. Розчинність оксигену у воді збільшується з підвищенням тиску та зниженням температури.
- Термічна стабільність: Є стійким при кімнатній температурі та тиску, але може піддалятися спонтанній окислювальній реакції при підвищених температурах.
- Магнітні властивості: Оксиген не має магнітних властивостей при кімнатній температурі та тиску.
- Інертність: Є інертним газом при кімнатній температурі та тиску, але може реагувати з більшістю елементів при підвищених температурах та тиску.
Ізотопи
Оксиген має декілька стабільних ізотопів, серед яких найбільш поширені:
- 16O (99,76%): це найбільш поширений ізотоп оксигену, який має 8 протонів і 8 нейтронів у ядрі.
- 17O (0,04%): це другий за поширенням стабільний ізотоп оксигену, який має 8 протонів і 9 нейтронів у ядрі.
- 18O (0,20%): це третій за поширенням стабільний ізотоп оксигену, який має 8 протонів і 10 нейтронів у ядрі.
Також існують декілька радіоактивних ізотопів оксигену, які мають дуже короткий час життя та використовуються в дослідженнях та медицині. Найбільш відомі з них – це 15O та 13O, які використовуються в позитронно-емісійній томографії (PET) для визначення об’єму кровообігу та функції органів.
Біологічна роль оксигену
Оксиген є життєво важливим елементом для більшості організмів на Землі, оскільки він необхідний для дихання та енергетичних процесів в клітинах.
У тварин оксиген використовується для забезпечення окислювальної фосфориляції, процесу, за якого відбувається створення енергії в клітинах. Для цього оксиген взаємодіє з глюкозою та іншими органічними сполуками, де відбувається процес окислення та виділення енергії.
У рослин оксиген використовується для проведення фотосинтезу. У цьому процесі рослини використовують енергію сонячного світла для превращения вуглекислого газу та води в глюкозу та кисень. Кисень, який виділяється під час фотосинтезу, потім використовується для дихання рослин.
Також має важливу роль у розкладі біологічних сполук, включаючи розклад органічного матеріалу та видалення токсинів з організму. Бактерії та гриби використовують оксиген у процесі біологічного розкладу органічних речовин, який є важливим для рециклінгу поживних речовин в екосистемах.
Водні організми також залежать від оксигену, оскільки він розчиняється у воді та використовується для дихання водних тварин, включаючи риб та безхребетних. Однак, відновлення кисню в океанах є нестабільним процесом, тому забруднення океанів та інші екологічні проблеми можуть впливати на рівень кисню в воді та здоров’я морських організмів.
Застосування оксигену
Оксиген має безліч застосувань у різних галузях. Ось декілька з найважливіших:
- Дихальний газ: Є найважливішим дихальним газом для людей і тварин. Він необхідний для розщеплення глюкози і інших хімічних реакцій, які забезпечують клітинам енергією.
- Медицина: Використовується у медицині для підтримки життєдіяльності пацієнтів з дихальними проблемами, такими як астма, ХОЗЛ, пневмонія тощо. Він також використовується в апаратах штучної вентиляції легень.
- Окислювач: Оксиген є потужним окислювачем і використовується у багатьох процесах, включаючи спалювання палива, виробництво стекла, сталі та інших металів.
- Озоновий шар: Озоновий шар на висоті близько 20-30 км над земною поверхнею складається з молекул трьохатомного кисню, які забезпечують захист від ультрафіолетового випромінювання. Хоча оксиген не є прямим складовим озонового шару, але він відіграє важливу роль у його формуванні.
- Побутове використання: Використовується в різних побутових приладах, таких як лампи зварювальні, пальники і газові плити. Також він використовується для зберігання продуктів харчування та напоїв.