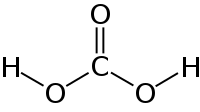
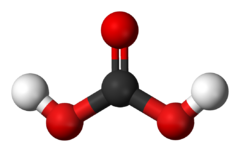
Карбонатна кислота (H2CO3) – це слабка кислота, яка утворюється при розчиненні вуглекислого газу (CO2) у воді.
Інша назва: вугільна.
У розчиненому стані карбонатна кислота розпадається на іон водню (H+) і карбонатний іон (CO32-):
H2CO3 ⇌ H+ + CO32-
Однак, карбонатна кислота досить нестійка і швидко розкладається на дві молекули води та вуглекислий газ:
H2CO3 ⇌ H2O + CO2
Хімічні властивості карбонатної кислоти
Карбонатна кислота в момент її утворення взаємодіє з активними металами, основними оксидами, лугами. При надлишку кислоти з лугами утворюється кисла сіль.
Наприклад:
H2CO3 + Mg → MgCO3 + H2
H2CO3 + CaO → CaCO3 + H2O
H2CO3 + 2NaOH → Na2CO3 + 2H2O
H2CO3 + NaOH → NaHCO3 + H2O
Карбонатна кислота (H2CO3) є досить нестійкою і швидко розкладається на два молекули води (H2O) та вуглекислий газ (CO2):
H2CO3 ⇌ H2O + CO2
Однак, хоча сама карбонатна кислота є нестійкою, її солі, відомі як карбонати, мають важливі хімічні властивості. Найпоширенішими карбонатами є натрій карбонат (Na2CO3) і кальцій карбонат (CaCO3), такі як мармур і вапняк.
Отримання
Карбонатну кислоту (H2CO3) можна отримати шляхом розчинення вуглекислого газу (CO2) у воді. Процес отримання карбонатної кислоти полягає в наступних кроках:
- Приготування вуглекислого газу: Вуглекислий газ можна отримати різними способами, наприклад, шляхом реакції карбонатних сполук з кислотами або розкладанням карбонатів при високій температурі. Найпоширеніший спосіб – це реакція кислоти з карбонатом, наприклад, реакція кислоти соляної (HCl) з карбонатом натрію (Na2CO3):
2HCl + Na2CO3 → 2NaCl + H2O + CO2
- Розчинення вуглекислого газу в воді: Отриманий вуглекислий газ розчиняють у воді за допомогою спеціальних устаткувань, наприклад, в справжніх або штучних карбонаторах. У процесі розчинення утворюється карбонатна кислота:
CO2 + H2O ⇌ H2CO3
Важливо знати, що карбонатна кислота є нестійкою і швидко розкладається на воду і вуглекислий газ:
H2CO3 ⇌ H2O + CO2
Отже, для збереження карбонатної кислоти у стабільному стані її необхідно утримувати у закритій системі, що унеможливлює виходження вуглекислого газу.
Застосування карбонатної кислоти
H2CO3 є слабкою кислотою і має обмежений практичний застосунок у чистому вигляді через її нестійкість. Однак, карбонатні сполуки, які утворюються з карбонатної кислоти, мають широке застосування. Основні застосування карбонатної кислоти та її сполук включають:
- Виробництво солей: Використовується для отримання різних карбонатних солей, таких як натрій карбонат (Na2CO3), кальцій карбонат (CaCO3) і багато інших. Ці солі мають велике застосування в різних галузях, включаючи склярну промисловість, виробництво миючих засобів, штукатурку, косметику і фармацевтику.
- Регулювання pH: Бікарбонатний іон (HCO3-) утворюється при розчиненні карбонатної кислоти у воді і використовується для регулювання pH в різних системах. Наприклад, в біологічних системах, таких як кров, бікарбонатна система відповідає за підтримку кислотно-лужного балансу.
- Лікування захворювань шлунково-кишкового тракту: Бікарбонатна кислота та її солі використовуються для лікування певних захворювань шлунково-кишкового тракту, таких як гастрит і виразки. Вони можуть допомогти зменшити кислотність шлункового соку і нейтралізувати надлишкову кислоту.
- Лужність води: Карбонатна кислота і її солі, зокрема натрій карбонат, використовуються для підвищення рівня лужності води.