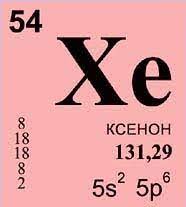Ксенон (Xe) – це хімічний елемент, який належить до благородних газів у періодичній таблиці.
Ось деякі загальні відомості про ксенон:
- Атомний номер: 54
- Атомна маса: 131.29 г/моль
- Група: 18
- Період: 5
- Електронна конфігурація: [Kr] 5s2 4d10 5p6
- Внешній електронний шар: 8 електронів
Фізичні властивості ксенону
Основні фізичні властивості ксенону (Xe) включають наступне:
- Агрегатний стан: Xe є благородним газом при нормальних умовах температури та тиску. Він не має кольору, запаху або смаку.
- Температура кипіння: Температура кипіння ксенону становить -108.13 °C (-162.63 °F). Це означає, що при цій температурі ксенон переходить у рідкий стан.
- Температура плавлення: Температура плавлення ксенону становить -111.79 °C (-169.22 °F). Це означає, що при цій температурі ксенон переходить з газоподібного стану у рідкий стан.
- Густина: Густина ксенону при нормальних умовах температури та тиску становить близько 5.894 г/л. В порівнянні з повітрям, ксенон є важчим газом.
- Розчинність: Ксенон є слабкорозчинним у воді та багатьох органічних розчинниках. Він проявляє невелику розчинність у різних матеріалах, таких як жирні речовини та полімери.
- Люмінесценція: Xe під дією високої електричної напруги може світитися яскраво блакитним світлом. Ця властивість ксенону використовується у ксенонових лампах та інших світлових джерелах.
- Інертність: Ксенон є хімічно інертним газом, тобто він майже не взаємодіє з іншими речовинами при нормальних умовах. Він стійкий до окиснення, горіння та хімічних реакцій.
Ці фізичні властивості ксенону роблять його корисним в різних застосуваннях.
Хімічні властивості ксенону
Хімічні властивості ксенону:
- Інертність: Ксенон є хімічно інертним газом. Він майже не взаємодіє з іншими речовинами при нормальних умовах, що робить його досить стійким і безпечним для багатьох застосувань.
- Формування сполук: Ксенон може утворювати сполуки з іншими елементами, зокрема з фтором, киснем, хлором та іншими. Сполуки ксенону, такі як ксенонові фториди, мають важливе значення в хімії і дослідженнях.
- Люмінесценція: Ксенон під дією електричної розрядки або лазерного випромінювання може світитися яскравим блакитним світлом. Це дозволяє використовувати ксенон в світлових джерелах, таких як ксенонові лампи.
- Анестетичні властивості: Ксенон має анестетичні властивості і використовується в медицині як агент для загальної анестезії.
- Застосування: Ксенон застосовується у світлових джерелах, лазерній технології, медицині, наукових дослідженнях та інших галузях, які вимагають хімічно стійкого та некорозійного газу.
Це загальна інформація про ксенон, існують ще багато деталей та застосувань, пов’язаних з цим благородним газом.
Ізотопи ксенону
Xe має більше 40 відомих ізотопів, але серед них декілька є стабільними. Ось деякі з найважливіших ізотопів ксенону:
- 124Xe: Стабільний ізотоп ксенону з 54 протонами і 70 нейтронами. Він має відносно низьку концентрацію у природі.
- 126Xe: Інший стабільний ізотоп з 54 протонами і 72 нейтронами. Він також має низьку концентрацію у природі.
- 129Xe: Це стабільний ізотоп з найбільшою концентрацією у природі. Він має 54 протони і 75 нейтронів. 129Xe є важливим у дослідженнях природного рідкого ксенону та газової хроматографії.
- 131Xe: Це радіоактивний ізотоп ксенону, який виникає в результаті розпаду радіоактивного йоду. 131Xe використовується в медицині для радіоізотопної діагностики та радіоізотопного лікування.
Крім цих стабільних ізотопів, Xe має ряд радіоактивних ізотопів, таких як 133Xe, 135Xe, 137Xe та багато інших. Ці радіоактивні ізотопи мають важливе значення в наукових дослідженнях, ядерній фізиці та медицині.
Отримання ксенону
Ксенон (Xe) можна отримати з різних джерел, включаючи повітря, природний газ та процеси ядерного розпаду. Ось кілька способів отримання ксенону:
- Фракційна дистиляція повітря: Xe можна отримати шляхом фракційної дистиляції рідкого повітря. У процесі заморожування повітря до низьких температур (-196 °C або -321 °F), його компоненти, включаючи ксенон, розділяються за допомогою фракційної дистиляції.
- Абсорбція ксенону з природного газу: Xe можна виділити з природного газу, який містить малий вміст ксенону. Це може бути досягнуто за допомогою спеціальних абсорбентів або мембран, які взаємодіють з іншими компонентами газу, а ксенон зберігається або виділяється.
- Ядерний розпад: Ксенон утворюється в результаті ядерного розпаду деяких важких радіоактивних елементів, зокрема радію (Ra) та урану (U). Цей процес відбувається природно в Земній корі та може бути використаний для одержання ксенону в ядерних дослідженнях.
- Хімічні реакції: Xe також може бути отриманий шляхом хімічних реакцій, зокрема реакцій з фтором. Наприклад, ксенон може утворювати ксенонові фториди (XeF2, XeF4, XeF6), які можуть бути виділені у вигляді газу або рідини.
Ці методи дозволяють отримати ксенон в різних чистотах та концентраціях залежно від потреби і застосування.
Застосування ксенону
Ксенон (Xe) має різноманітні застосування у різних галузях. Ось кілька основних застосувань ксенону:
- Світлові джерела: Ксенонові лампи використовуються у світлових джерелах, таких як автомобільні фари та проектори. Ксенонове світло є яскравим, білим та має високу інтенсивність, що дозволяє використовувати його у додаткових автомобільних фарах та освітленні великих приміщень.
- Медицина: Xe використовується як агент для загальної анестезії під час хірургічних операцій. В порівнянні з іншими анестетиками, ксенон вважається більш безпечним і має менший вплив на дихальну та серцево-судинну системи.
- Ядерна енергетика: Xe використовується в ядерних реакторах як модератор для сповільнення нейтронів. Він має властивість поглинати швидкі нейтрони та змінювати їх на повільніші, що сприяє утриманню ядерних реакцій.
- Електроніка: Ксенон використовується в газорозрядних трубках, які застосовуються в електронних пристроях, наприклад, у фотоапаратах та лазерних принтерах.
- Дослідження та аналітика: Xe використовується у наукових дослідженнях, зокрема у ядерній фізиці, фізиці високих енергій та дослідженнях планетної атмосфери. Крім того, ксенонові газові хроматографи використовуються для аналізу зразків у хімічних та біологічних лабораторіях.
Це лише кілька загальних прикладів застосувань ксенону. Завдяки своїм унікальним фізичним та хімічним властивостям, ксенон знаходить застосування в багатьох інших галузях, таких як астрономія, лазерна технологія, метрологія та багато інших.